Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
Юридическая компания «Пепеляев Групп» информирует о том, что с 1 сентября 2023 года биологически активные добавки, кожные антисептики, отдельные виды медицинских изделий и иные товары будут подлежать обязательной маркировке средствами идентификации.
О маркировке по порядку
Правительство РФ утвердило старт обязательной маркировки для БАД, отдельных видов медицинских изделий, антисептиков и кресел-колясок, приняв четыре постановления.
Заявления на регистрацию в ИС подаются с 1 сентября 2023 г. Сделать это нужно в течение 7 календарных дней со дня возникновения необходимости осуществления участником оборота товаров деятельности, связанной с вводом в оборот, и (или) оборотом, и (или) выводом из оборота. В течение 15 календарных дней с момента регистрации в системе надо подготовить собственное ПО к информационному взаимодействию с ИС и направить оператору заявку на тестирование.
Важно учитывать, что коды маркировки предоставляются за плату, за исключением случая, когда участник оборота решил начать маркировать продукцию до введения обязательной маркировки, в таком случае коды предоставляются бесплатно. При этом коды надо будет оплатить, если они не преобразованы в средства идентификации и в ИС не представлен отчет об их нанесении до 30 сентября 2023 г.
Получение кодов маркировки возможно посредством заключения договора между оператором и участником оборота товаров. На данный момент типовые формы договора на оказание услуг по предоставлению кодов маркировки, разработанные Минпромторгом РФ, проходят антикоррупционную экспертизу . Полагаем, что в ближайшее время они в той или иной редакции будут утверждены.
С 1 октября 2023 г. производители и импортеры указанных товаров аптечного ассортимента обязаны наносить на упаковку вышеуказанных видов продукции средства идентификации.
Требования и сроки
Общие требования для подключения участников оборота к ИС:
Требования для розничных продавцов, использующих контрольно-кассовую технику:
Важно отметить, что участники должны будут фиксировать передачу товара через систему ЭДО с оформлением универсальных передаточных документов (далее – УПД). В этой связи необходимо учитывать особенности договора, который заключается между оператором и участником оборота товаров:
Сроки внедрения маркировки различны в зависимости от вида товара. Начало обязательной маркировки – это еще не запрет оборота немаркированных товаров. Систему обязательной маркировки и прослеживания товаров внедряют в несколько этапов: сначала регистрация у оператора, потом нанесение кодов на товары и внесение информации в систему, затем запрет оборота без маркировки.
В отношении БАД и антисептиков
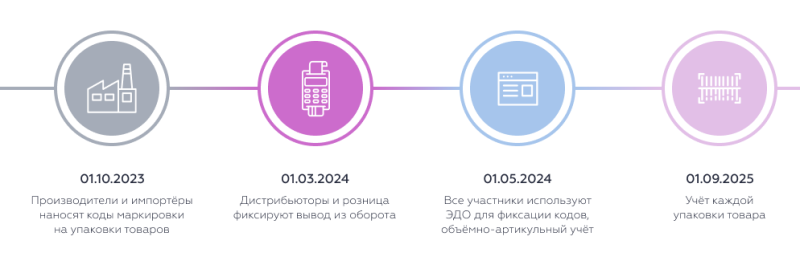
В отношении отдельных видов медицинских изделий
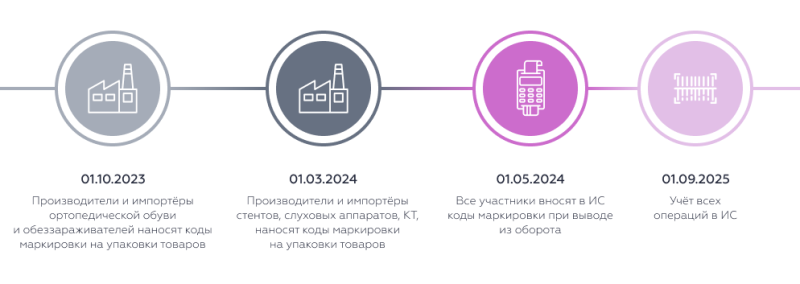
В отношении кресел-колясок

Чем может грозить отсутствие маркировки?
После перехода к учету всех операций с индивидуальными кодами в ИС, оборот немаркированной продукции будет запрещен. То есть реализовывать или иным образом выводить из оборота БАД, кожные антисептики и отдельные виды медизделий без внесения в ИС кодов маркировки после 01 сентября 2025 г. будет запрещено. Для кресел-колясок этот срок наступит раньше ― с 1 сентября 2024 г.
В действующем законодательстве РФ предусмотрена административная и уголовная ответственность за отсутствие маркировки, порядка ее нанесения, а также внесения сведений в ИС.
О чем подумать, что сделать
С учетом происходящих изменений юристы «Пепеляев Групп» готовы оказать необходимую правовую поддержку по вопросам, прямо или косвенно связанным с обязательной маркировкой товаров.
Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Какие нормативно-правовые акты регулируют маркировку лекарств
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
Медицинские организации должны:
Эта статья была полезной?
Подключитесь к ЭДО для маркировки
Заполните заявку вручную или загрузите сертификат ЭП
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.













No comment